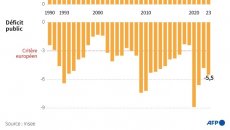
Économie
contenus affichés
-
09:53France - JO-2024: la flamme va être remise aux Français avant de quitter la Grèce
-
09:47Économie - La Bourse de Paris progresse de 0,25%, les résultats d'entreprises plutôt bien reçus
-
09:40Sports - Nantes : Kombouaré se lâche sur les primes de Montpellier
-
09:38Économie - Uruguay: entre prospérité et précarité dans le pays le plus cher d'Amérique latine
-
08:00Auto - La Grande Collecte du Sport : et si on donnait une seconde vie à notre vélo ?