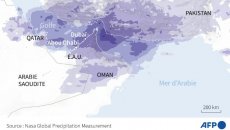
Économie
contenus affichés
-
09:00Sports - L1 (J30) : Tout savoir sur Nice - Lorient
-
08:59France - En Haute-Vienne, les moines, le maire et les villageois
-
08:28Politique - 100 jours à Matignon : Gabriel Attal revient sur son expérience de Premier ministre
-
08:25Économie - Travaux publics: patronat et syndicats autour de la table pour améliorer l'"attractivité" du secteur
-
08:00Auto - MOD Easy SideCar 3 : le vélo side-car vintage et électrique