Économie
contenus affichés
-
00:54Monde - Ukraine: la Russie frappe le rail pour bloquer les livraisons militaires
-
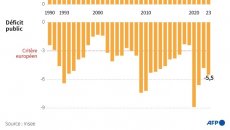
00:39Économie - France : le gouvernement échappe à la sanction de Fitch et Moody's
-
00:27Monde - Sexe, argent et tabloïds, la première semaine de débats s'achève au procès Trump
-
26/04Sports - Toulouse : Un nouveau stade en 2028 ?
-
26/04Auto - La Grande Collecte du Sport : et si on donnait une seconde vie à notre vélo ?