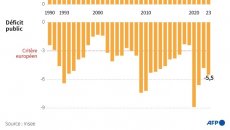
Économie
contenus affichés
-
09:01Sports - OM : Ça s'active autour d'une prolongation de Balerdi
-
08:59Politique - Délinquance : Gérald Darmanin se dit "favorable" au couvre-feu pour les mineurs
-
08:53Économie - Mines: Anglo American rejette une offre de son rival BHP à 38,8 milliards de dollars
-
08:35Monde - Guatemala: perquisition d'une ONG soupçonnée de "maltraitance" d'enfants
-
08:00Auto - La Grande Collecte du Sport : et si on donnait une seconde vie à notre vélo ?
Vidéos
Tous publics

Raphaël Glucksmann sur la GPA: "Quand elle n'est pas commerciale, je suis pour"
26 avril 2024 - BFMTV